熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
摘要:氧氣(O?)是生命活動的關鍵分子,但其濃度異常(缺氧或高氧)可導致細胞代謝紊亂甚至毒性損傷。近年來,丹麥Unisense公司開發的微電極系統憑借其高靈敏度、微米級空間分辨率和實時動態監測能力,在氧氣生理學及氧毒性機制研究中發揮了重要作用。本文綜述了Unisense微電極的技術原理、在細胞/組織氧微環境監測中的應用案例,并探討其在氧化應激、線粒體功能、微生物-宿主互作等研究中的最新進展,以期為相關領域的研究者提供方法學參考。
1.引言
氧氣是需氧生物能量代謝的核心底物,但細胞內O?濃度梯度(如線粒體附近低氧vs.質膜附近高氧)的失衡可引發活性氧(ROS)爆發,導致DNA損傷、蛋白質氧化及脂質過氧化。傳統氧檢測方法(如Clark電極、熒光探針)受限于空間分辨率或侵入性,難以精準解析微尺度氧動態。丹麥Unisense公司開發的微氧電極系統(如OX-MR、OX-10等)通過微米級傳感尖端(1–50μm)和低噪聲信號放大技術,實現了對生物樣本(單細胞、組織、微生物群落)O?通量的無損監測,成為氧氣生理學和氧毒性機制研究的革命性工具。
2.Unisense微電極技術原理與優勢
2.1技術原理
Unisense微電極基于電化學傳感原理(Clark型或極譜型),核心組件包括:
微傳感尖端:鉑/金陰極與銀陽極構成,表面覆蓋O?選擇性膜(如聚四氟乙烯),僅允許O?擴散進入。
高阻抗放大器:檢測O?還原電流(pA級),線性響應范圍0–100%O?飽和濃度。
三維微操縱系統:精度達1μm,支持活體樣本的動態掃描(如腫瘤球、植物根際)。
2.2核心優勢
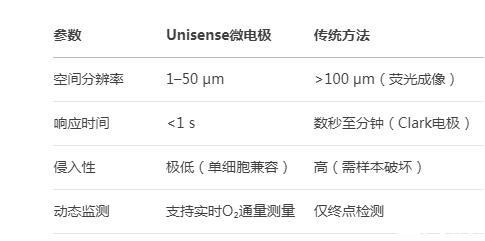
參數Unisense微電極傳統方法
空間分辨率1–50μm>100μm(熒光成像)
響應時間<1 s數秒至分鐘(Clark電極)
侵入性極低(單細胞兼容)高(需樣本破壞)
動態監測支持實時O?通量測量僅終點檢測
3.在氧氣生理學研究中的應用
3.1細胞微環境氧動態
腫瘤缺氧研究:
Unisense微電極揭示實體瘤內部O?梯度(如核心區<mmHg vs.邊緣區>20 mmHg),結合HIF-1α免疫熒光,證實缺氧誘導的代謝重編程(Warburg效應)【案例:Cancer Res.(2018)】。
線粒體氧消耗:
通過測量單個線粒體周圍O?濃度下降速率,量化電子傳遞鏈(ETC)活性,發現ROS爆發與復合體I功能障礙的關聯【案例:Cell Metab.(2020)】。
3.2植物氧氣生理
根際氧化圈繪圖:
在水稻根表掃描顯示,根尖O?滲出量高達200 nmol/cm2/h,而成熟區因木質化導致O?擴散受限,解釋了側根發生的氧依賴性【案例:New Phytol.(2019)】。
藻類光合產氧:
微電極實時監測硅藻(Thalassiosira)光合層O?超飽和(>300%空氣飽和值),為海洋碳泵模型提供數據支持。
4.在氧毒性機制研究中的突破
4.1高氧誘導的氧化應激
新生兒高氧肺損傷:
利用Unisense系統發現,高氧(>80%O?)暴露下,肺泡II型上皮細胞周圍O?濃度驟升,觸發NADPH氧化酶(NOX2)依賴性ROS產生【案例:Am.J.Respir.Crit.Care Med.(2021)】。
神經退行性疾病:
在帕金森病模型中,黑質致密部O?波動加劇線粒體復合體I缺陷,導致多巴胺能神經元凋亡。
4.2微生物氧毒性防御
腸道菌群互作:
雙歧桿菌(Bifidobacterium)通過分泌超氧化物歧化酶(SOD),降低腸黏膜表面O??水平,維持宿主-菌群穩態(Unisense數據驗證)【案例:Nature Microbiol.(2022)】。
5.技術挑戰與解決方案
挑戰Unisense優化方案
生物膜污染自清潔涂層電極(如聚乙烯吡咯烷酮)
多參數同步監測整合pH/H?S微電極(MultiSensor系統)
活體長時間記錄無線微型化探頭(如Rat O2 Telemetry)
6.未來展望
Unisense微電極的進一步發展將聚焦于:
納米化傳感:結合碳納米管提升單分子O?檢測靈敏度。
人工智能分析:通過機器學習預測O?梯度-生理響應的非線性關系。
臨床轉化:術中實時監測缺血再灌注損傷組織的氧恢復動態。
7.結論
Unisense微電極系統通過其無可比擬的微尺度氧監測能力,推動了從基礎氧氣生理學到氧毒性臨床干預的研究。未來,該技術與其他組學(代謝組、微生物組)的整合,有望揭示更復雜的氧依賴生命過程。
 相關新聞
相關新聞