熱線:021-66110810,66110819
手機(jī):13564362870


熱線:021-66110810,66110819
手機(jī):13564362870
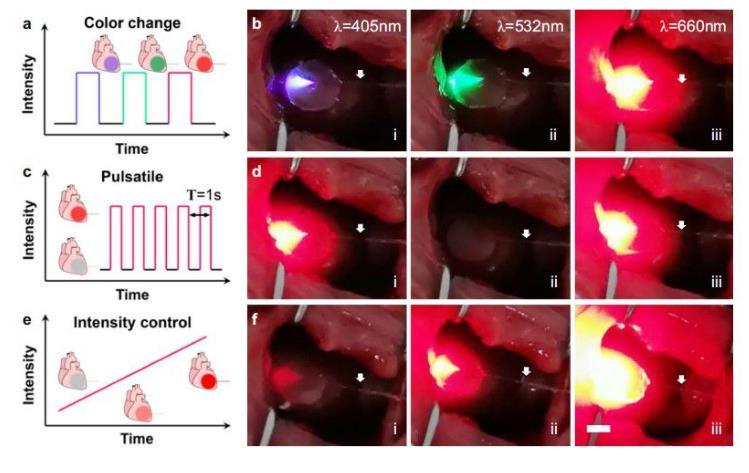
圖3、展示iCarP照明對(duì)大鼠心臟的不同模式。a、b iCarP支持照明的顏色變化,同一設(shè)備發(fā)出的光為(i)405 nm,(ii)520 nm,(iii)660 nm。c、d脈沖照明1 Hz,(i)、(ii)、(iii)顯示開關(guān)的開啟和關(guān)閉。e、f iCarP隨著時(shí)間的推移逐漸增加照明強(qiáng)度。白色箭頭表示光纖。
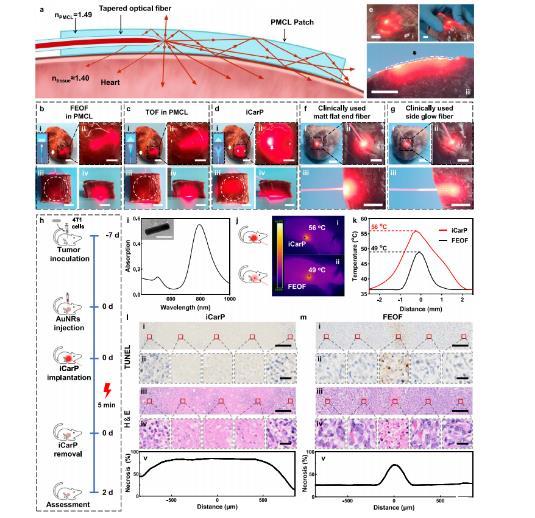
圖4、不同光纖/貼片光子器件的照明范圍和深度以及腫瘤光熱消融效果的比較。a iCarP光學(xué)路徑的橫截面示意圖。b–d被光子器件照明的離體豬心的全景圖(i)和放大圖像(ii):平面光纖(FEOF)在PMCL中(b),TOF在PMCL中(c),以及iCarP(d),插圖:光纖端結(jié)構(gòu)和相應(yīng)的光散射圖示,(i)比例尺=2.5厘米;(ii)比例尺=1厘米。白色箭頭表示光纖。頂視圖(iii)和正視圖(iv)的1.5厘米厚心臟組織,被相應(yīng)的光子器件照亮(器件完全被心臟組織覆蓋;它們的位置用白色圓圈標(biāo)出),比例尺=1厘米。e iCarP照明對(duì)離體豬心的影響,比例尺=1厘米。白色箭頭表示光纖,黑色箭頭表示空氣間隙的位置。(i)iCarP以較低功率照明的豬心,與(d)中的情況相比,顯示了散射光的分布。(ii)iCarP照明扭曲的豬心。(iii)iCarP和豬心肌的橫截面,與(a)中的配置相同。f、g臨床上使用的啞光平端光纖(f)和側(cè)發(fā)光光纖(g)的照明范圍和深度。離體豬心的全景圖(i)、放大圖像(ii)和橫截面(iii)。比例尺=1厘米。h動(dòng)物研究的時(shí)間線。i金納米棒的光吸收譜,插圖:>100金納米棒的代表性透射電鏡圖像。比例尺=50微米。j iCarP(i)和FEOF(ii)照明的小鼠的紅外熱成像。k iCarP(i)和FEOF(ii)照明的小鼠的溫度。l、m iCarP(l)和FEOF(m)照明的治療效果(代表性的n=3個(gè)生物獨(dú)立樣本)。(i)照明腫瘤的代表性TUNEL染色圖像,比例尺=200微米。(ii)TUNEL染色圖像,比例尺=20微米。(iii)照明腫瘤的代表性H&E染色圖像,比例尺=200微米。(iv)放大的H&E染色圖像,比例尺=20微米。(v)基于H&E染色的壞死的定量分析。
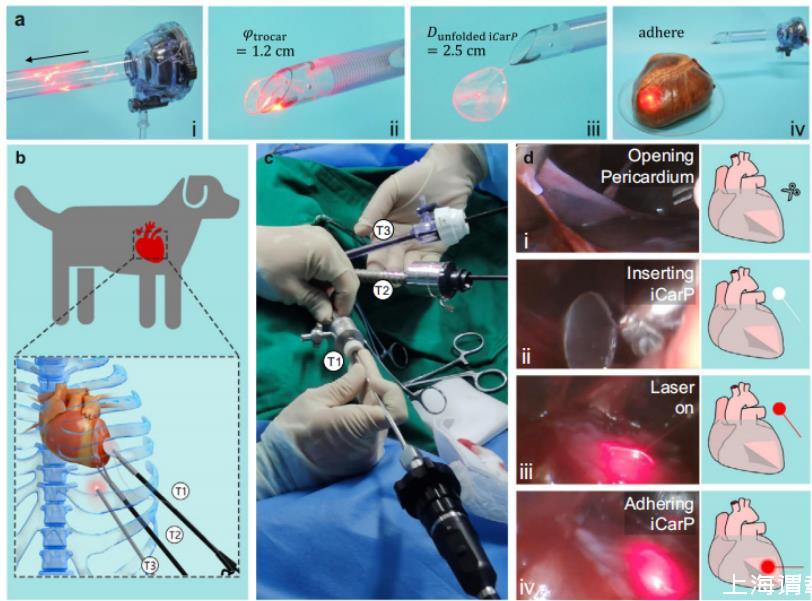
圖5、iCarP與微創(chuàng)植入兼容。a iCarP在經(jīng)過(guò)切口器的穿透:(i)折疊的iCarP(直徑2.5厘米)插入切口器(直徑1.2厘米),(ii)iCarP通過(guò)切口器的出口,(iii)iCarP通過(guò)切口器穿過(guò)并展開,(iv)展開的iCarP粘附在豬心表面。b在犬模型中進(jìn)行微創(chuàng)植入iCarP的示意圖。T1:用于抓取鑷子的切口器;T2:用于彎曲剪刀的切口器;T3:用于內(nèi)窺鏡的切口器。c在犬模型中進(jìn)行微創(chuàng)植入iCarP的胸腔鏡下植入。d iCarP植入的步驟示意圖:(i)開放心包;(ii)插入iCarP;(iii)打開照明;(iv)粘附iCarP。
結(jié)論與展望
在光譜、面積、深度和強(qiáng)度方面具有高度可控性和適應(yīng)性的內(nèi)臟和組織的診斷和治療照明仍然是一個(gè)重大挑戰(zhàn)。研究人員提出了一種稱為iCarP的柔性、可生物降解的光子器件,該器件在折射聚酯貼片和嵌入的可移除錐形光纖之間具有微米級(jí)的氣隙。ICarP結(jié)合了錐形光纖的光衍射、氣隙中的雙重折射和貼片內(nèi)部的反射等優(yōu)點(diǎn),獲得了燈泡狀照明,將光引導(dǎo)向目標(biāo)組織。
研究表明iCarP在不刺穿目標(biāo)組織的情況下實(shí)現(xiàn)了大面積、高強(qiáng)度、寬光譜、連續(xù)或脈動(dòng)、深度穿透照明,并證明它支持不同光敏劑的光療。研究發(fā)現(xiàn)光子設(shè)備與基于胸腔鏡的微創(chuàng)植入到跳動(dòng)的心臟上是兼容的。這些初步結(jié)果表明,iCarP可能是一種安全、精確和廣泛應(yīng)用的設(shè)備,適用于內(nèi)臟和組織照明以及相關(guān)的診斷和治療。本研究不僅在技術(shù)上取得了創(chuàng)新,還為未來(lái)體內(nèi)光療的臨床應(yīng)用提供了新的可能性。iCarP的設(shè)計(jì)和應(yīng)用展示了其在提高光療效果、減少組織損傷和提高患者安全性方面的潛力。
隨著進(jìn)一步的研究和開發(fā),這種光子貼片可能會(huì)在心血管疾病、腫瘤治療以及其他需要光療干預(yù)的領(lǐng)域發(fā)揮重要作用。Unisense微電極在本研究中發(fā)揮了關(guān)鍵作用,通過(guò)監(jiān)測(cè)藻類的光合作用產(chǎn)生的氧氣,驗(yàn)證了iCarP光子貼片的光照效果和生物醫(yī)學(xué)應(yīng)用潛力。氧氣微電極通過(guò)監(jiān)測(cè)光照過(guò)程中藻類懸浮液中溶解氧濃度的變化,幫助研究人員評(píng)估iCarP產(chǎn)生的光照是否能夠有效促進(jìn)藻類的光合作用。這對(duì)于評(píng)估iCarP在生物醫(yī)學(xué)中的應(yīng)用前景非常重要,因?yàn)樗枰_保光照能夠有效地激活生物過(guò)程。這表明iCarP能夠有效地將光能量傳遞到目標(biāo)區(qū)域,并且光照強(qiáng)度和分布足以支持光合作用的進(jìn)行。這些數(shù)據(jù)支持了iCarP作為一種光子設(shè)備在生物醫(yī)學(xué)應(yīng)用中的有效性,特別是在需要光合作用來(lái)產(chǎn)生氧氣的治療場(chǎng)景中,例如心肌梗死治療。
 相關(guān)新聞
相關(guān)新聞