熱線:021-66110810,66110819
手機:13564362870


熱線:021-66110810,66110819
手機:13564362870
03.使用3DFG MEA進行細胞外和細胞內記錄
我們按照先前報道的協議將誘導多能干細胞來源的心肌細胞(hiPSC-CMs)培養在3DFG MEA上。培養至少3天后,誘導多能干細胞來源的心肌細胞(hiPSC-CMs)獲得自發且規律的電活動和機械收縮。3DFG MEA能夠檢測到2D心臟培養物的自發動作電位,信噪比約為27分貝。細胞外動作電位呈現出典型的負相和預期的Q相(Na+峰值)短于30毫秒。培養物的自發跳動頻率約為每分鐘60次,這與誘導多能干細胞來源的心肌細胞(hiPSC-CMs)的預期相符。正如先前的研究中所觀察到的那樣,在生理條件下,即在沒有用于穿孔細胞膜的任何外部刺激的情況下,使用3DFG電極進行的細胞內動作電位記錄不會發生。這表明盡管細胞與材料之間形成了緊密的黏附,但3DFG并不會自發地被心肌細胞內化。
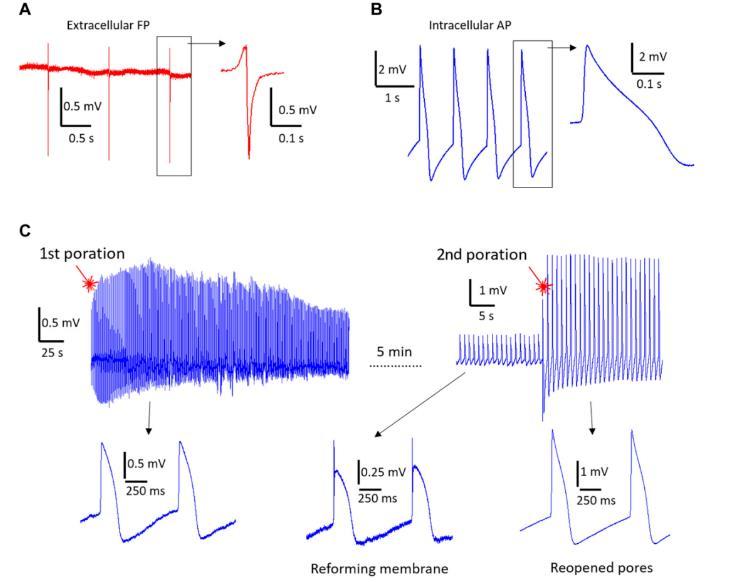
圖3電生理記錄。(A)使用50微米電極的3DFG-MEA對誘導多能干細胞來源的心肌細胞(hiPSC-CMs)進行的代表性體外場電位(FP)記錄。(B)激光照射后在50微米電極的3DFG-MEA上進行的代表性細胞內動作電位(AP)記錄。(C)激光照射后細胞膜修復以及體外場電位信號重新出現時細胞內耦合的時間穩定性。右側顯示,用激光第二次刺激心肌細胞,產生新的孔隙并恢復細胞內AP記錄。
用1064納米超快脈沖激光以約1毫瓦的功率進行刺激,獲得了細胞內AP,表明3DFG在激光脈沖照射下成功實現了細胞膜的光穿孔。激光刺激后獲得的信號顯示單相正峰,平均持續時間為206±28毫秒(以562個AP的50%振幅計算)。所獲取的信號呈現出預期的心臟動作電位成分,即初始的急劇去極化階段、輕微的復極化隨后是較長的平臺期以及最終的復極化階段。細胞膜光穿孔可能歸因于在超快脈沖激光照射期間,3DFG電極發射出熱載流子。正如先前的研究中所報道的那樣,這些熱載流子處于熱力學非平衡狀態,能量很高,能夠在與3DFG的界面處形成電子等離子體。如果局部熱載流子密度超過某一閾值,電子等離子體的弛豫及其與水分子的碰撞會導致產生空化納米氣泡,從而局部破壞細胞膜。熱電子與水分子的碰撞使其平均自由程限制在電解質-材料界面附近的幾十納米內。因此,光穿孔事件極其局限于激光激發的小區域(聚焦光斑直徑約為2微米)。由于大部分光能都用于發射電子,整個過程不會影響局部溫度(不產生熱量)。
我們對分布在三個不同的人誘導多能干細胞心肌細胞培養物中的六個3DFG多電極陣列進行了細胞穿孔電生理實驗(包括下一節中的實驗)。3DFG實現局部光穿孔的成功率高達90%,與使用其他材料獲得的先前結果一致。在3DFG多電極陣列上獲取的細胞內動作電位幅度從幾百微伏到5至6毫伏不等(平均細胞內動作電位約為3.56±1.96毫伏),信噪比高達43分貝。在我們的實驗中,穿孔后可獲得的最大幅度受到采集系統規格的限制。幅度高于6毫伏的細胞內動作電位有可能被記錄下來,但放大器的飽和會失真這些信號,因此被丟棄。
平均而言,5微米的3DFG超微電極比50微米的微電極能獲取到幅度更高的動作電位。這可歸因于電極尺寸較小,導致光穿孔后密封電阻更高。為了突出3DFG-MEAs多通道細胞內記錄的優勢,我們在圖S6中報告了一個在同一MEA上多個3DFG電極同時進行細胞內記錄的示例。我們通過將MEA設備置于激光束下移動,并隨后在同一樣本上對多個電極進行光穿孔來獲得這些測量值。由于所有光穿孔事件可在幾秒內完成,而細胞內信號穩定幾分鐘,因此我們有充足的時間窗口,可同時從多個3DFG電極記錄細胞內動作電位。對于心肌細胞,這些多點測量有助于繪制合胞體中信號傳播的模式和速度,并通過增加分析細胞的數量來提高數據的可靠性。圖S6還提供了所獲取細胞內信號變化性的見解。我們可以觀察到,信號的幅度因光穿孔后細胞內耦合程度的不同而有所差異。然而,各細胞中信號的形狀及其持續時間仍保持相對穩定,其變化處于商業hiPSC-CM系列中典型的心臟類型變異性范圍內。
與使用其他微電極材料時觀察到的情況一樣,在3DFG上的光穿孔過程是非侵入性的,因為可以在同一細胞上重復多次。在圖3C所示的例子中,在首次光穿孔事件后幾分鐘內記錄到的細胞內動作電位(AP)幅度約為1.5 mV。隨著細胞膜的修復,信號幅度降低,細胞外場電位(FP)的形狀再次變得明顯。此時,我們在靠近首次激發的位置(距離首次激發幾微米)再次激發細胞,以使完全細胞內動作電位的形狀立即恢復。第二次穿孔后的信號幅度更高,達到約3 mV。然而,首次穿孔事件和第二次穿孔事件期間動作電位(AP)的持續時間并無差異。此外,在首次和第二次穿孔事件期間,培養物的跳動頻率也保持不變。平均而言,多次光穿孔事件后記錄的動作電位幅度更高,這是由于相對于總細胞-電極粘附面積,細胞內耦合面積增加所致。從長遠來看,通過延長單次光穿孔事件后3DFG的細胞內耦合,也可能實現更長序列的細胞內動作電位記錄。為實現這一目標,未來3DFG MEA的配置中可以采用文獻中的各種策略。用作3DFG生長模板的突出納米結構可通過促進細胞吞噬作用和誘導細胞膜彎曲來促進細胞內耦合,而細胞膜彎曲反過來又能激活局部內吞作用蛋白的募集。為了更好地評估3DFG結合光穿孔技術的細胞內記錄性能,我們在表S1中報告了我們技術的主要特點以及其他在心肌細胞上測試的方法的特點。