熱線:021-56056830,66110819
手機:13564362870


熱線:021-56056830,66110819
手機:13564362870
2結(jié)果
圖1為煙草葉片首先受到ST的激發(fā),5 s過后,再受到1 s的紅光照射的ΔA515-550曲線,光強為1024μmol/m2·s。單周轉(zhuǎn)飽和光的激發(fā)使ΔA515-550信號迅速上升,然后以雙指數(shù)型在大約3 s內(nèi)衰減至0。通過曲線擬合,可以得到兩個指數(shù)加和形式的衰減方程為:
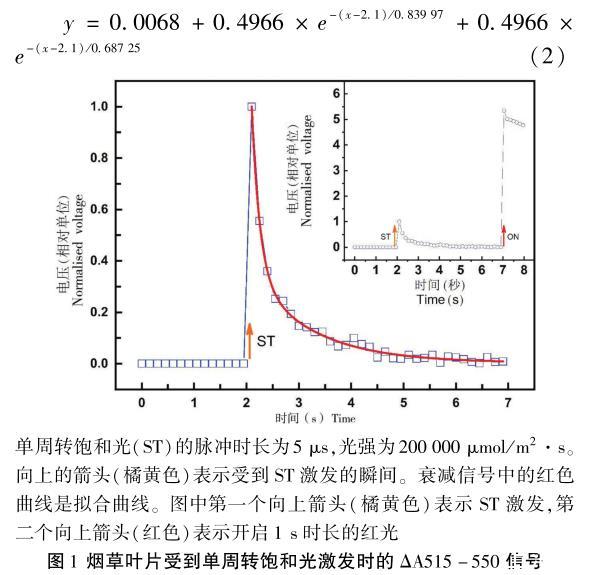
在單周轉(zhuǎn)飽和光激發(fā)的條件下,ΔA515-550信號的衰減呈現(xiàn)明顯的雙指數(shù)階段,擬合方程的第一個指數(shù)項的冪是1/0.839 97(底為e-1)要小于第二個指數(shù)項的冪1/0.687 25,因此ΔA515-550信號在第一階段以更快的速度衰減,在第二階段衰減的速度比第一階段要慢。
樣品首先用單周轉(zhuǎn)飽和光激發(fā),5 s后,時長為1 s的可見光開啟,ΔA515-550信號可達到的最大值是受到ST激發(fā)的P515信號最大值的大約5倍。
ΔA515-550曲線在1 s可見光照射下,呈現(xiàn)明顯的雙峰特征(圖2)。在可見光開啟后,第一個峰值迅速形成;第二個峰值在大約100 ms出現(xiàn)。雙峰之間產(chǎn)生了一個低谷。曲線最終在1 s內(nèi)衰減了大約30%。這種雙峰模式符合文獻中記錄的1 s可見光入射的測量曲線。
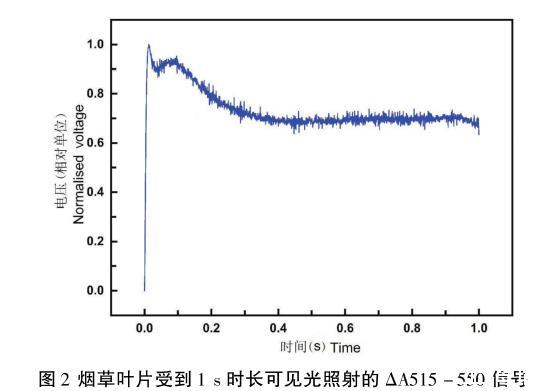
圖2煙草葉片受到1 s時長可見光照射的ΔA515-550信號
圖3中顯示了光照60 s并在光源關閉后記錄之后的120 s煙草葉片的ΔA515-550信號,此信號特征與先前Schreiber等測量的信號以及Johnson等測量的信號完全符合。此信號的特征為:光源開啟后的ΔA515-550信號迅速達到峰值,隨后在接下來的30 s內(nèi),信號衰減到峰值的50%左右。然后信號緩慢地提升至60 s左右達到穩(wěn)態(tài)。當關閉光源時,ΔA515-550信號迅速下降至最低點,然后緩慢上升直至達到另一個穩(wěn)態(tài)。
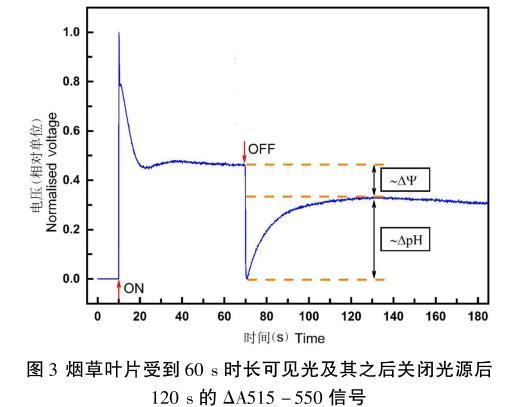
圖3煙草葉片受到60 s時長可見光及其之后關閉光源后120 s的ΔA515-550信號
3討論與結(jié)論
測量C3植物葉片的類囊體跨膜電勢可以采用微電極刺入的方法,但無論是電極直接刺入法還是改進的膜片鉗技術,微電極法都要求葉綠體的尺寸足夠大,例如Vredenberg等在微電極法中所使用的銀道椒草(Peperomiametallica)或角苔類(Anthoceros)的葉綠體,再者,微電極刺入膜內(nèi)所產(chǎn)生的刺口處的電流流失對于跨膜電壓測量也會產(chǎn)生不可控的損失。因此,測量電勢引起的葉綠素分子的吸收峰遷移,即測量P515信號這樣一種無損樣本,靈敏迅捷的方法,現(xiàn)已成為實驗室測量葉綠體跨膜電勢的一種常用技術手段。
在圖1中,葉片受到單周轉(zhuǎn)飽和光的激發(fā)時,P515信號的快速上升反映了在光反應中心(PSI和PSII)發(fā)生的初級電荷分離反應以及后續(xù)在細胞色素b6/f發(fā)生的次級電荷轉(zhuǎn)移反應。隨后的電信號衰減則反映了質(zhì)子的跨膜傳導過程,較快的電信號衰減可能是ATP合成酶被激活而形成的質(zhì)子傳導所造成的,而較慢的衰減則可能是藉由類囊體膜中離子通道的質(zhì)子傳導所造成的。
在圖2中,P515信號的雙峰特征并不是必然會出現(xiàn),特別是第二個峰會因為待測量的樣本品種以及待測樣品的生理狀態(tài)不同而不同。Bulychev和Vredenberg通過同時測量樣品的葉綠素熒光以及跨膜電勢發(fā)現(xiàn),跨膜電勢的第二個峰值在時間上與熒光曲線的一個瞬時下降相關聯(lián),這可能是由下列光化學反應所造成的葉綠素熒光淬滅:質(zhì)體藍素(Pc)攜帶的電子傳遞至光化學反應中心I(PSI),并最終傳遞至鐵氧還蛋白-NADP+-氧化還原酶(FNR)的化學反應過程。
在圖3中,關閉光源后,ΔA515-550信號急劇下降至最低點,隨后又緩慢地恢復上升到另一個穩(wěn)態(tài),這個穩(wěn)態(tài)就被稱為所謂的“黑暗基線”,根據(jù)Kramer和Scaksteder首創(chuàng)的“DIRK”分析,即暗黑區(qū)間弛豫分析(Dark interval relaxation kinetics)法,黑暗基線至有光時的穩(wěn)態(tài)信號線的差值反映了在光照時跨膜的電勢差(ΔΨ)的大小,而黑暗基線至關閉光源時,P515信號下降的最小值點的差值反映了在光照時跨膜pH值的大小。因此,對暗黑適應后的樣品進行P515信號的測量,不僅可以得知關于跨膜電勢的信息,也可以獲知關于跨膜化學勢的數(shù)據(jù),因此,最終也可定量地獲得跨膜質(zhì)子動勢的大小。因此,P515光譜測定方法是一種可以測量跨膜電勢差、跨膜ΔpH以及跨膜質(zhì)子動勢差的有力武器,可為深入研究C3作物光合過程原初反應的能量轉(zhuǎn)換的分子機制提供技術支持。
本研究以煙草葉片作為實驗樣品,使用雙通道脈沖振幅可調(diào)式葉綠素熒光儀(Dual-PAM-100),并搭配最新設計的P515/535雙組件模塊,得出樣本在單周轉(zhuǎn)飽和光、1 s可見光及60 s可見光的P515光譜變化結(jié)果,并詳細分析其形成原因。結(jié)果顯示,P515光譜測定法是一種可以測量跨膜電勢差、跨膜ΔpH以及跨膜質(zhì)子動勢差的靈敏迅捷、無損樣本的探測技術,可為今后農(nóng)業(yè)生產(chǎn)中的C3作物高光效品種的選育提供技術支持。
 相關新聞
相關新聞